感染性骨缺損在臨床上非常常見,其緻病菌主要爲金黃(huáng)色葡萄球菌[1]。交通事(shì)故和爆炸傷的增多使其發病率逐漸上升[2]。長期靜(jìng)脈應用抗生(shēng)素治療感染性骨缺損可(kě)導緻身(shēn)體(tǐ)毒性。載抗生(shēng)素的聚甲基丙烯酸甲酯(polymethyl methacrylate,PMMA)已被廣泛用于治療骨感染性疾病[3]。PMMA的優點是可(kě)在局部獲得(de)較高的藥物濃度,避免了靜(jìng)脈用藥的副作用;其主要缺點是不可(kě)降解、不能釋放(fàng)全部藥物[4]。基于目前研究現狀,研發一種具有良好生(shēng)物相(xiàng)容性、藥物緩釋性能、可(kě)控吸收、良好生(shēng)物力學性能的骨修複材料對治療感染性骨缺損具有重要意義。
納米羟基磷灰石(nano-hydroxyapatite,n-HA)的結構與人(rén)體(tǐ)骨組織相(xiàng)似[5],其具有良好的生(shēng)物活性和相(xiàng)容性,n-HA被認爲是最有前途的骨修複材料之一[6]。n-HA負載萬古黴素複合材料已成功用于治療感染性骨缺損[7]。聚氨酯(polyurethane,PU)是一種可(kě)生(shēng)物降解的材料,已被廣泛用于骨組織工(gōng)程[8]。納米羟基磷灰石/聚氨酯(n-HA/PU)多孔骨修複支架材料具有優良的生(shēng)物相(xiàng)容性和成骨作用。介孔二氧化矽納米粒子(mesoporous silica nanoparticles,MSNs)由Kresge等[9]首次發現,具有大(dà)孔體(tǐ)積、可(kě)控孔徑、高比表面積等特點,已被廣泛應用于生(shēng)物納米技術和納米醫學領域[10]。許多藥物和生(shēng)物分(fēn)子,如(rú)DNA或siRNA封裝在MSNs中用于治療癌症[11]。左氧氟沙星是一種從(cóng)氧氟沙星中分(fēn)離(lí)出來(lái)的Ⅲ類氟喹諾酮類抗生(shēng)素。其抗菌性能是氧氟沙星的2倍,具有低分(fēn)子量,通過靜(jìng)電吸引易于與MSNs結合。本研究以多孔n-HA/PU複合支架作爲載體(tǐ),将含有抗生(shēng)素的MSNs分(fēn)布于其多孔表面,合成了一種新型介孔矽納米微球載藥控釋抗菌骨修複材料,并評價該新型複合支架材料的體(tǐ)外緩釋性能及其治療感染性骨缺損的療效。
1.1 材料
24隻新西蘭兔由菏澤醫學專科(kē)學校(xiào)動物實驗中心提供,其中雌性12隻,雄性12隻,體(tǐ)重在2 ~ 4 kg之間,單籠飼養。動物生(shēng)産許可(kě)證号:[SCXK(魯)-2018-0006],動物使用許可(kě)證号:[SYXK(魯)-2019-0019]。本實驗研究經菏澤醫學專科(kē)學校(xiào)附屬醫院倫理(lǐ)委員會審核并通過(2021-016),并嚴格遵守“3R”原則。
蓖麻油、甘油、十六烷基三甲基溴化铵(CTAB)、原矽酸四乙酯(TEOS)(中國(guó)阿拉丁有限公司);1,4-丁二醇(BDO)和辛酸亞錫(中國(guó)成都(dōu)科(kē)龍有限公司);左氧氟沙星、甲醛溶液、乙酸乙酯(中國(guó)國(guó)藥集團化學試劑有限公司);聚甲基丙烯酸甲酯粉末(Palacos R+G,德國(guó)Heraeus Medical GmbH公司)。高效液相(xiàng)色譜儀(LC-2010AHT,日(rì)本島津公司);超聲波清洗器(KQ2200B,昆山(shān)市超聲儀器有限公司);高速離(lí)心機(D-37520,美國(guó)Sigma公司);循環恒溫水浴鍋(TB-85,日(rì)本島津公司);組織勻漿機(T10 basic S25,德國(guó)IKA公司);Micro CT掃描儀(μCT40,瑞士Scanco醫療);Scanco醫療系統(SC5073,μCTv6.1版,瑞士Scanco醫療);硬組織切磨系統(E300CP,德國(guó)EXAKT公司)。
1.2.5 植入材料
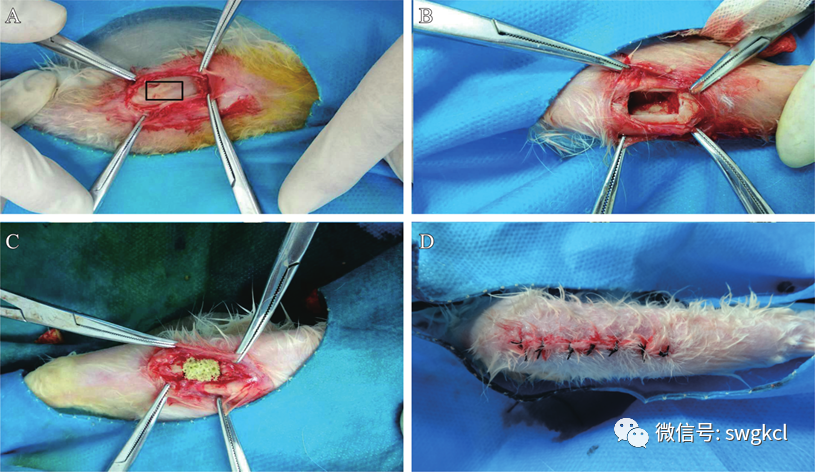
圖1 植入材料的過程:A. 暴露胫骨,選定清創區域與大(dà)小(10 mm×6 mm);B. 徹底清創并開窗(chuāng);C. 植入複合支架材料;D. 逐層縫合
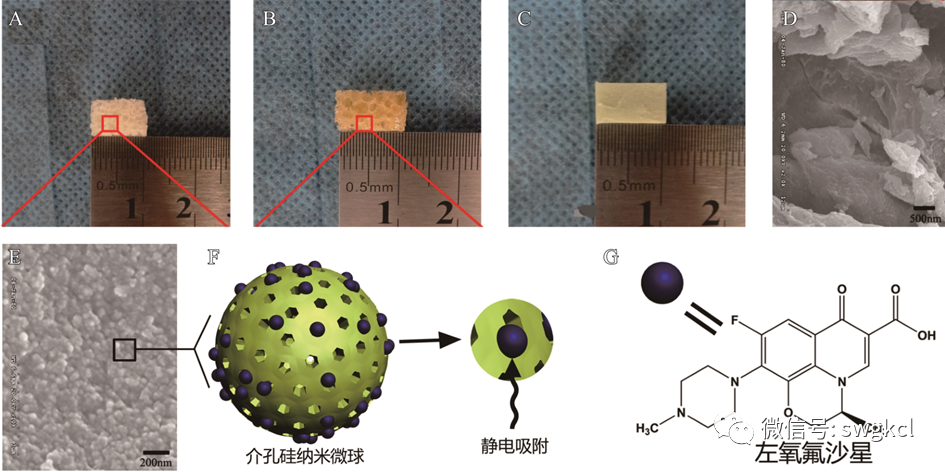
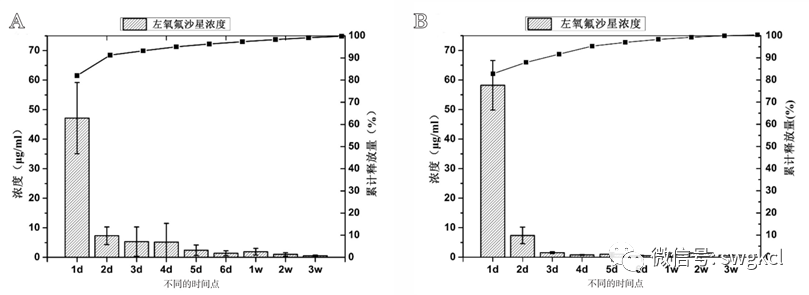
圖2 新合成的多孔複合支架材料:A. 空白(bái)n-HA/PU支架材料;B. 載抗生(shēng)素後的n-HA/PU材料;C. 載抗生(shēng)素的PMMA;D. 空白(bái)n-HA/PU的掃描電鏡圖;E. 1 mg Lev/n-HA/PU材料的掃描電鏡圖;F. 左氧氟沙星與MSNs結合的模式圖;G. 左氧氟沙星的分(fēn)子結構
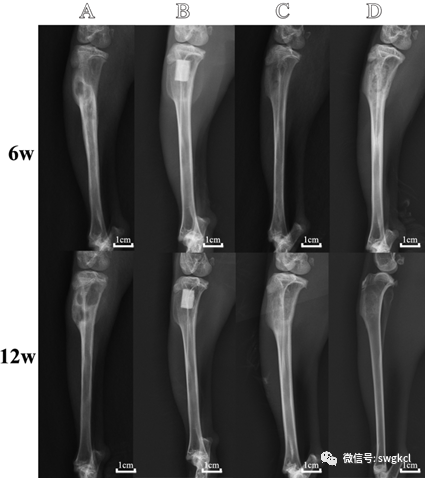

在植入後6周時,單純清創組可(kě)見骨破壞和骨缺損。n-HA/PU組和1 mg Lev/n-HA/PU組的複合支架保持完整沒有降解。在n-HA/PU組和1 mg Lev/PMMA組中,可(kě)見支架材料周圍少量的新骨形成。在1 mg Lev/n-HA/PU組的支架周圍觀察到新的骨小梁形成。在植入後12周的時間點,單純清創組表現爲胫骨局部骨缺損,無明顯新生(shēng)骨。在1 mg Lev/n-HA/PU組中,新生(shēng)的骨小梁緊密地附着在複合支架上,幾乎填滿了整個骨髓腔。然而在n-HA/PU組和1 mg Lev/PMMA組中隻能觀察到很少的新生(shēng)骨小梁。各組植入後的3D重建如(rú)圖5所示。
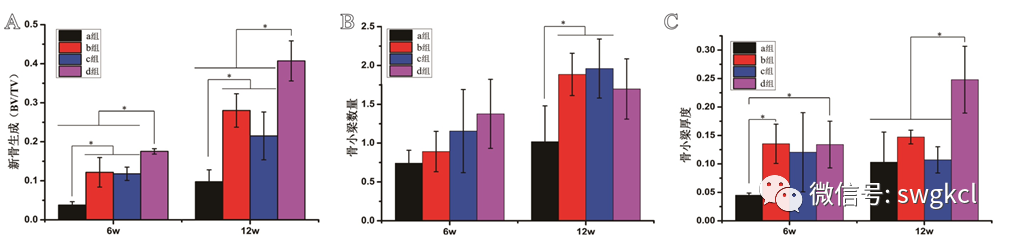
在植入後6周時,1 mg Lev/n-HA/PU組的新骨生(shēng)成量(BV/TV)均與其餘三組有統計(jì)學差異(P<0.05)。在植入後12周時,1 mg Lev/n-HA/PU組的新骨生(shēng)成量(BV/TV)均高于其餘三組(P<0.05,見圖6)。同時,n-HA/PU組與1 mg Lev/PMMA組的新骨生(shēng)成均高于單純清創組(P<0.05)。在植入後6周時,各組之間新生(shēng)骨小梁的數量比較,差異無統計(jì)學意義(P>0.05)。在植入後12周時,n-HA/PU組與1 mg Lev/PMMA組的新生(shēng)骨小梁的數量均高于單純清創組(P<0.05)。在植入後12周時,1 mg Lev/n-HA/PU組的新生(shēng)骨小梁的厚度均與其餘三組差異有統計(jì)學意義(P<0.05)。
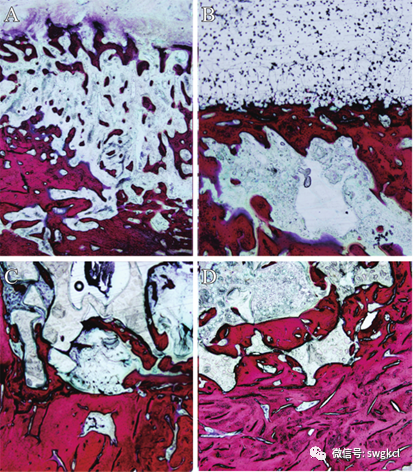
在植入後12周時由于炎症反應導緻骨破壞,單純清創組骨質較稀疏(見圖7A)。在1 mg Lev/PMMA組材料表面,可(kě)見明顯界限,有新生(shēng)骨小梁遷延生(shēng)長(見圖7B)。在n-HA/PU組、1 mg Lev/n-HA/PU組材料的内部,新生(shēng)骨小梁沿孔隙生(shēng)長。其中1 mg Lev/n-HA/PU組材料與骨小梁相(xiàng)互纏繞,結合緊密(見圖7)。
感染性骨缺損的治療需徹底清除死骨和感染的軟組織,同時靜(jìng)脈應用抗生(shēng)素4 ~ 6周[18]。其主要缺陷是局部的抗生(shēng)素濃度達不到最小抗菌濃度,同時長期靜(jìng)脈應用抗生(shēng)素會對身(shēn)體(tǐ)産生(shēng)毒性,給患者帶來(lái)巨大(dà)的經濟負擔,對外科(kē)醫生(shēng)來(lái)講是一個巨大(dà)的挑戰。因此,局部應用抗生(shēng)素治療感染性骨缺損成爲了骨科(kē)學者研究的熱(rè)點。
本研究中,筆者将負載左氧氟沙星的MSNs與n-HA/PU相(xiàng)結合,合成了一種新型複合支架材料,用于治療感染性骨缺損。體(tǐ)外實驗證實了其具有良好的藥物緩釋性能。将其植入動物體(tǐ)内12周後,新型複合支架材料具有良好生(shēng)物相(xiàng)容性、抗感染能力、骨誘導能力,以期爲感染性骨缺損的治療提供新的解決方案。
技術服務咨詢 步經理(lǐ) 18910422384
 官方微信
官方微信艾瑪赫(北京)科技有限公司 地址:北京市經濟技術開發區地盛南(nán)街1号1幢3041室
2020@ 艾瑪赫(北京)科技有限公司